Επιστροφή στο
αρχικό μενού
ΟΔΗΓΙΕΣ ΓΙΑ ΤΗΝ ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ ΕΠΑΛΗΘΕΥΣΗΣ ΤΩΝ ΝΟΜΩΝ ΤΩΝ ΙΔΑΝΙΚΩΝ ΑΕΡΙΩΝ
ΠΑΡΑΤΗΡΗΣΕΙΣ:
- Η πίεση στο όργανο μετριέται σε mbar. Θα πρέπει να γνωρίζουμε ότι 1atm=1013,25mbar. Έτσι για να βρούμε την πίεση, κάθε φορά προσθέτουμε στην ένδειξη του μανομέτρου τον αριθμό 1013 και οι μονάδες μέτρησης είναι σε mbar.
- Ο όγκος του δοχείου είναι 140ml . Έτσι για να βρούμε κάθε φορά τον όγκο, προσθέτουμε στην ένδειξη της σύριγγας τον αριθμό 140 και οι μονάδες είναι σε ml.
ΜΕΛΕΤΗ ΤΟΥ ΝΟΜΟΥ ΤΟΥ BOYLE
Βήμα 1ο
Ανοίγουμε και τις δύο στρόφιγγες. Θέτουμε τη σύριγγα στα 60ml. Στη συνέχεια κλείνουμε τη στρόφιγγα που δεν επικοινωνεί με την σύριγγα.
Βήμα 2ο
Πιέζουμε τη σύριγγα και παίρνουμε τις παρακάτω ενδεικτικές μετρήσεις. Προτείνουμε να πάμε από τα 60ml της σύριγγας κατευθείαν στα 40ml ώστε να έχουμε μια σαφή ένδειξη στο μανόμετρο. Συμπληρώνουμε τον παρακάτω πίνακα
|
Ενδείξεις σύριγγας (ml) |
Ενδείξεις μανομέτρου (mbar) |
Όγκος αερίου Σε ml |
Πίεση Αερίου Σε mbar |
Αντίστροφο του
όγκου *104 |
|
60 |
0 |
200 |
1013 |
50,0 |
|
40 |
25 |
180 |
1038 |
55,6 |
|
30 |
100 |
170 |
1113 |
58,8 |
|
20 |
170 |
160 |
1183 |
62,5 |
|
10 |
260 |
150 |
1273 |
66,7 |
|
0 |
370 |
140 |
1383 |
71,4 |
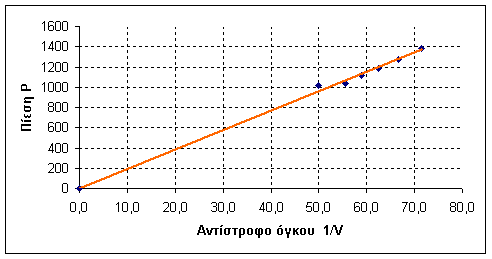
Η γραφική παράσταση έγινε με τη βοήθεια του EXCEL. Παρατηρούμε ότι τα σημεία μας είναι πάνω σε ευθεία ( προτείνουμε για καλύτερη προσέγγιση να μην λάβετε υπόψη την πρώτη τιμή ) πράγμα που φανερώνει ότι τα δύο μεγέθη P και 1/V είναι ανάλογα.
Τι παριστάνει η κλίση της ευθείας;.
ΕΠΑΛΗΘΕΥΣΗ ΤΟΥ ΝΟΜΟΥ ΤΟΥ CHARLES
( Ισόχωρη μεταβολή )
Βήμα 1ο
Κλείνουμε και τις δύο βάνες ώστε να δουλέψουμε μόνο με το αέριο του θερμιδομέτρου.
Βήμα 2ο
Τοποθετούμε τις μπανάνες του τροφοδοτικού στο θερμιδόμετρο οπότε διαρρέεται η αντίσταση από ρεύμα και το αέριο του δοχείου ζεσταίνεται. Τοποθετούμε το ηλεκτρονικό θερμόμετρο στην υποδοχή του θερμιδομέτρου και αρχίζουμε να παίρνουμε μετρήσεις μετά από λίγο που θα αυξάνεται η πίεση αργά – αργά. Για τη μέτρηση της θερμοκρασίας προσθέτουμε πάντα το 273. Συμπληρώνουμε τον πίνακα
|
Ενδείξεις Θερμομέτρου σε βαθμούς Κελσίου |
Ενδείξεις μανομέτρου (mbar) |
Θερμοκρασία σε
βαθμούς Κέλβιν |
Πίεση Αερίου Σε mbar |
|
35,5 |
230 |
308,5 |
1243 |
|
37,5 |
240 |
310,5 |
1253 |
|
39,5 |
250 |
312,5 |
1263 |
|
42,8 |
260 |
315,8 |
1273 |
|
45,1 |
265 |
318,1 |
1278 |
|
46,1 |
270 |
319,1 |
1283 |
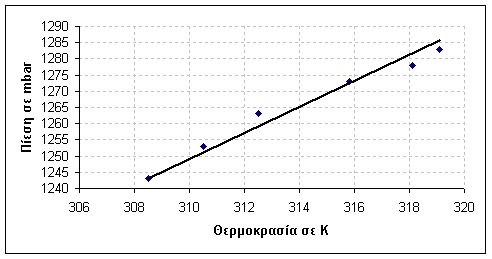
ΕΠΑΛΗΘΕΥΣΗ ΤΟΥ ΝΟΜΟΥ ΤΟΥ GAY-LUSSAC (Ισοβαρής μεταβολή )
Προτείνουμε η επαλήθευση του νόμου να γίνει μόνο ποιοτικά. Ζεσταίνοντας το αέριο παρατηρούμε να αυξάνεται ο όγκος της σύριγγας. Μετρήσεις ακριβείας δεν μπορούμε να πάρουμε αφού η σύριγγα είναι πλαστική και έτσι η τριβή είναι μεγάλη. Επειδή η στατική τριβή δεν έχει σταθερή τιμή η πίεση μεταβάλλεται αρκετά κοντά στο μηδέν του μανομέτρου, το οποίο όμως σε εκείνη την περιοχή δεν έχει καλή ευαισθησία.
Μπορούμε να πάρουμε πολύ καλύτερες μετρήσεις αν αντικαταστήσουμε τη σύριγγα με γυάλινη που θα βρούμε σε παλιά φαρμακεία.
ΚΑΙ ΜΙΑ ΠΑΡΑΤΗΡΗΣΕΙΣ ΓΙΑ ΑΥΤΟΥΣ ΠΟΥ ΤΑ ΨΑΧΝΟΥΝ…
Γιατί στη μελέτη ισόχωρης μεταβολής η μεταβολή της πίεσης με τη θερμοκρασία είναι αρχικά πολύ απότομη και στη συνέχεια είναι πολύ πιο αργή τόσο στο ζέσταμα όσο και στο κρύωμα του αερίου;
Αυτό συμβαίνει γιατί η μεταβολή που περιγράφει το φαινόμενο είναι εκθετική.
Απόδειξη.
Ο ρυθμός με τον οποίο προσφέρουμε θερμότητα μέσω της ωμικής βατικής αντίστασης είναι σταθερός. Έστω Ρ*. Ο ρυθμός όμως με τον οποίο χάνεται θερμότητα προς το περιβάλλον εξαρτάται από τη διαφορά θερμοκρασίας του αερίου με το περιβάλλον. Από την άλλη ο ρυθμός με τον οποίο προσλαμβάνει θερμότητα το αέριο είναι ανάλογο της διαφοράς θερμοκρασίας. Έτσι έχουμε :
![]() (1)
(1)
το Α είναι μια σταθερά που εξαρτάται από το εμβαδόν του δοχείου καθώς και από τη θερμική του αγωγιμότητα.
Καλώ θ1=θ-θπερ οπότε η σχέση (1) μετατρέπεται στη σχέση:
![]() (2)
(2)
καλώ Αθ1-P*=θ2 και έχω:
![]() (3)
(3)
η λύση της παραπάνω διαφορικής είναι
![]()
Άρα ![]()
Όταν ζεσταίνουμε το αέριο για t=0 έχουμε θ=θπερ οπότε από την παραπάνω σχέση θα έχουμε:
![]() και η σχέση
γίνεται :
και η σχέση
γίνεται :
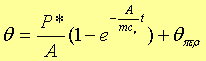
Ó Πάνος Μουρούζης Σεπ-2008